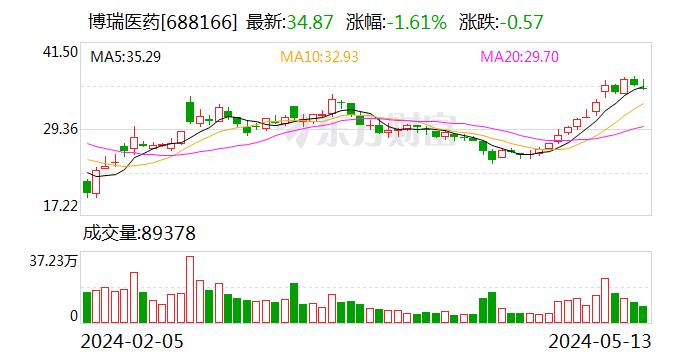
依库珠单抗注射液在我国获批上市,可解决临床急需!
文 | 健识局 冯晨晨
编 | Shirely
今日,国家药品监督管理局发文,称其已批准依库珠单抗注射液(英文名:Eculizumab Injection)的进口注册申请,将用于治疗成人和儿童阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)。
据了解,阵发性睡眠性血红蛋白尿症(PNH)是一种血细胞表面内源性补体抑制物的获得性造血干细胞克隆性疾病;非典型溶血性尿毒症综合征(aHUS)与遗传性或获得性的补体途径失调相关。PNH和aHUS属于全球罕见疾病,依库珠单抗注射液通过抑制补体途径免疫反应控制上述两种疾病的病情。
依库珠单抗注射液由瑞士Alexion公司研发,由杭州泰格医药科技股份有限公司代理申报进口注册。基于该产品属临床急需品种,国家药监局药品审评中心将其纳入优先审评程序进行审评。
此外,专家评估认为,由于该产品已在国外获批上市,临床疗效明确,风险可控,同意豁免本品注册临床试验;同时考虑到增加儿童适应症将给儿童人群带来的获益大于风险,建议一并批准。但要求申请人应补充本品上市后的有效性和安全性信息,按计划继续开展临床试验,并动态修订风险管理计划。
依库珠单抗的加快上市,可以更好地满足临床需求,为患者治疗提供更多选择。
今年以来,国务院常务会议两次专题研究加快已在境外上市新药进口问题,提出对治疗罕见病的药品和防治严重危及生命的部分药品简化上市要求。
国家药监局对此表示,将加快研究出台简化境外上市新药审批的政策措施。
查看原文 >>