它是臭名昭著的興奮劑,也是諾獎夢開始的地方
摘要:這些不負責生成EPO的其他細胞中必定含有某些分子(比如負責開啓基因表達的轉錄因子)能夠感受到氧氣濃度的變化,結合到低氧應答元件上開啓EPO等基因的表達。然而某些體育競技工作者也開始動重組人源EPO的歪腦筋了,如果用EPO類型人工重組激素刺激運動員體內產生更多的紅細胞,就有可能提高運動員獲取氧氣和產生能量分子的能力,也就能夠提高運動員在自行車、長跑、越野滑雪等耐力項目中的成績。
來源:科學大院
它是一種激素,也是治療貧血的神奇藥物,它成就了生物技術的獨角獸Amgen,也擊潰了環法七冠王,就在四天前,它又帶來了諾獎。

(圖片來源:veer圖庫)
2019年諾貝爾生理學或醫學獎的三位得主William G。 Kaelin, Jr。、Gregg L。 Semenza和Sir Peter J。 Ratcliffe早在2016年就以細胞對低氧感知與適應機制的研究斬獲了諾獎風向標——拉斯克基礎醫學獎,所以也沒有讓人特別意外。三人發現和鑑定的關鍵分子低氧誘導因子1 (hypoxia-inducible factor 1, HIF-1)一時間也在朋友圈爆紅。今天我們希望回到這一項研究的起點——促紅細胞生成素(erythropoietin,縮寫EPO),一個神奇的分子。
它,是紅細胞生成的最重要因素
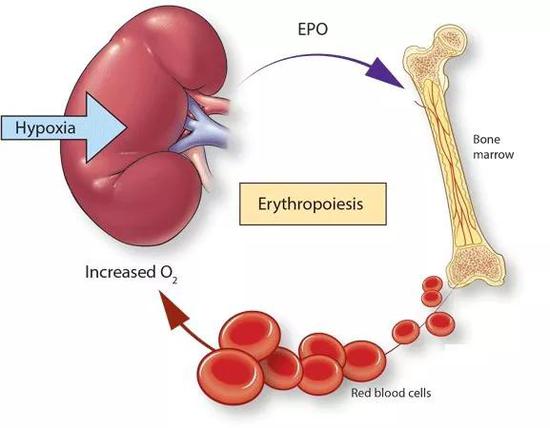
紅細胞是血液中數量最多的一種血細胞,是脊椎動物體內通過血液運送氧氣和二氧化碳的最主要媒介。紅細胞在骨髓中生成:造血幹細胞首先增殖分化爲各類血細胞的祖細胞,其中紅系祖細胞能夠進一步分化成熟爲紅細胞。正常情況下人類的紅細胞生成速率很低,但在出血、溶血以及缺氧等脅迫壓力下,紅細胞的生成速率甚至可以提高8倍。在這一過程中,促紅細胞生成素EPO是最重要的因素,沒有之一。
EPO是一種主要在腎臟合成的激素,化學本質是一種有高度糖基化修飾的蛋白質。爲什麼是在腎臟?每分鐘有1升左右的血液流經腎臟,所以腎臟能夠快速有效地監測到血液中氧含量的變化。當血液中氧含量較低時,腎臟就會快速響應,大量合成EPO。後者通過血液循環進入骨髓,促進其中的紅系祖細胞向紅細胞的轉變。成熟的紅細胞從骨髓中被釋放到循環系統,以提高機體對氧氣結合能力。腎臟感受到血液中氧氣濃度增加後會減少EPO的合成,進而降低骨髓中的紅細胞含量。
這就構成了一個完美的調節閉環。而高原生活的人以及一些貧血患者常常碰到血氧含量持續低的狀況,就無法完成上述循環,刺激腎臟持續分泌EPO,使其血液中的EPO濃度高於常人。
花了近80年才揭開它的真面目
和很多重大發現類似,科學家對EPO的認識不是一帆風順的,一路伴隨着質疑、挑戰。從EPO概念的提出到最終確定具體的分子花了接近80年的時間。
1906年,法國科學家Carnot 和Deflandre給正常的兔子輸注了貧血兔子的血清後,發現正常兔子血漿裏紅細胞計數增加,他們認爲血漿中某種體液因子能夠刺激調節紅細胞的生成。這就是最早的EPO概念原型。遺憾的是隨後幾十年裏研究者並沒有成功重複這一實驗結果,一個的主要原因是當時對新生紅細胞的計數定量並不精準。
1950年Reissmann和Ruhenstroth-Bauer的異種共生實驗給出了真正有力的證據。他們通過外科手術將兩隻活體大鼠的循環系統連接在一起,將其中一隻置於低氧環境,另一隻呼吸正常的空氣,結果兩隻老鼠的體內都大量生成了紅細胞。毫無疑問,血液循環系統中存在一種能夠刺激紅細胞生成的激素,促紅細胞生成素EPO由此得名。另一方面也說明EPO對低氧非常敏感。
EPO究竟是一個什麼分子?美國科學家Goldwasser用了30年的時間,最終在生物化學水平闡明瞭這個問題。工欲善其事,必先利其器。EPO的功能是能刺激新生紅細胞,但後者的計數定量並不精準。紅細胞裏最主要的功能分子是含有血紅素的血紅蛋白,血紅素分子中心含有一個亞鐵離子,所以Goldwasser研究組用放射性的鐵同位素標記新生的紅細胞,建立了靈敏檢測EPO活力的方法,使得從動物體液樣本分離純化濃度極低的EPO(每毫升納克級)變得可能。但EPO的分離還是異常艱難的,他們的研究對象從腎臟換成貧血綿羊血漿、轉向因鉤蟲感染而嚴重缺鐵的病人尿液,最後在1977年從2550升日本再生障礙性貧血患者的尿液中純化得到8毫克的人EPO蛋白。
1985年,人源EPO的蛋白質測序以及基因克隆得以完成。EPO基因編碼了一段193個氨基殘基的多肽,在分泌過程中剪切掉信號肽後成爲166個氨基酸殘基組成的成熟蛋白質,含有4個發生糖基化修飾的位點。1998年,EPO核磁共振溶液結構以及EPO及其受體複合物晶體結構得到解析。至此,人們對EPO纔有了最直觀的認識。
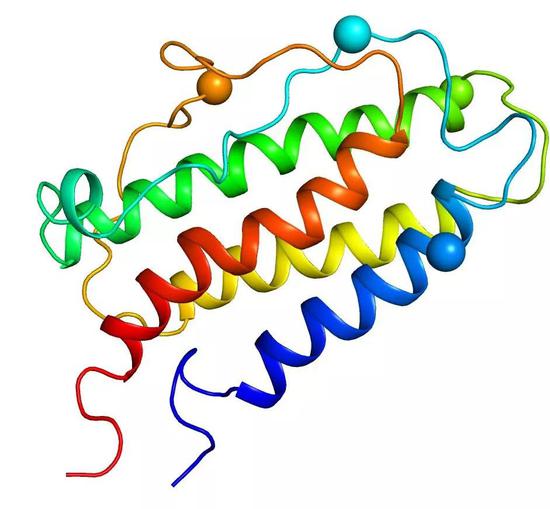
EPO的三維結構(PDB code:1BUY, PYMOL 軟件出圖),球狀標示爲糖基化位點
它,催生了製藥巨頭
在此之前,治療貧血一般需要通過輸血補充紅細胞的不足。隨着人們對EPO的認識不斷深入,通過注射EPO刺激自身骨髓的紅細胞生成讓問題變得更加簡單。但像Goldwasser那樣直接從體液純化EPO非常困難,產量也很低。而EPO蛋白質和基因序列的測定,使得大量生產重組人源EPO成爲可能。
完成這一創舉的是一家叫做Applied Molecular Genetics(Amgen,安進)的生物技術公司。Amgen成立於1980年,一開始只有7名成員,他們希望用當時興起的分子生物學技術實現生物製藥,在他們目標的清單上有干擾素、生長激素釋放因子、乙肝疫苗、表皮生長因子這些火熱的名字,然而這些嘗試無一成功。直到1985年,來自中國臺灣的華人科學家林福坤克隆了人EPO的基因,進而利用DNA重組技術實現了人工合成的EPO生產。
重組人源EPO和人體內源的EPO蛋白質一級序列相同,也具有類似的糖基化修飾,自然也具有內源EPO的活力。1989年6月Amgen的第一個產品重組人紅細胞生成素Epogen獲得美國FDA批准,用於治療慢性腎功能衰竭引起的貧血和HIV感染治療的貧血。Epogen銷售額短短的三個月之內就突破了1600萬美元。隨後的20年裏,Amgen在重組人源EPO市場裏始終處於統治地位。僅2010年Epogen就給Amgen帶來了高達25億美元的收入。2018年,Amgen的股票市值1288億美元,位列全球製藥巨頭第八位。
值得一提的是,Amgen一開始正是同Goldwasser合作,由Goldwasser提供純化的人EPO蛋白進行測序,但很快Goldwasser和Amgen因理念不合而分道揚鑣。而從事基礎研究的Goldwasser及其所在的芝加哥大學從來都沒有想過爲他發現的這種激素申請專利,所以沒有因爲EPO商業上巨大的成功獲得一分錢。
它,怎麼就成了興奮劑
在我們呼吸過程中,氧氣進入細胞的線粒體驅動呼吸鏈,同時大量產生ATP,這是我們身體裏能量的主要來源。貧血的人體內缺乏足夠的健康紅細胞,最直接的影響是吸收的氧氣不足,令人覺得乏力,類似長跑力竭時呼吸不暢的感覺。注射重組人源EPO後,貧血患者的機體能產生更多的紅細胞,運載更多的氧氣,伴隨着更多能量分子ATP的產生,有效地緩解了症狀。
然而某些體育競技工作者也開始動重組人源EPO的歪腦筋了,如果用EPO類型人工重組激素刺激運動員體內產生更多的紅細胞,就有可能提高運動員獲取氧氣和產生能量分子的能力,也就能夠提高運動員在自行車、長跑、越野滑雪等耐力項目中的成績。1980年《應用生理學》一篇論文表示,血液興奮劑(促紅細胞生成素、人工氧載體和血液回輸等)可以使人體耐力增加34%。若運動員使用EPO,他們在跑步機上跑8公里的時間將比之前縮短44秒。事實上,自行車和馬拉松一直都是EPO類興奮劑的重災區。1998年環法自行車賽期間,西班牙費斯蒂納車隊的一名隊醫在法國邊境被捕,她竟然隨身攜帶了400瓶人工重組EPO藥物!結果當然是整支車隊被踢出了環法並禁賽。
1992年巴塞羅那奧運會上,國際奧委會就把EPO列爲了違禁藥物名單,但是,重組人源EPO檢測非常困難,在2000年奧運會之前甚至沒有方法能有效地檢測出運動員是否使用。原因有幾種:1)人體液中EPO含量極低,正常人每毫升血液中EPO約爲130-230納克;2)人工重組EPO與人體內源EPO蛋白質氨基酸組成完全一樣,僅僅是糖基化形式有非常細微的不同;3)EPO在血液中的半衰期僅爲5-6小時,一般在最後一次注射的4-7天后就檢測不到;4)EPO水平的個體差異性大,很難設立絕對的定量標準。
2000年開始,世界反興奮劑機把尿檢作爲直接檢測重組EPO唯一科學的驗證方法。由於人工重組EPO與人體內源EPO糖基化形式的些微差別,兩種分子的帶電性質有非常小的不同,能用一種名爲“等電聚焦”的電泳方法區分開,這是直接法檢測人工重組EPO的主要策略。但是,某些用人來源細胞表達的重組EPO就沒有糖基化差別,所以也有專家建議用碳同位素含量的不同區分外源EPO和內源EPO。
EPO是耐力性項目選手經常使用的違禁藥物(圖片來源:http://sportsscientists.com/wp-content/uploads/2013/02/EPO.jpg)
其實,目前不同的EPO檢測方法都還存在侷限,比如美國自行車傳奇人物蘭斯·阿姆斯特朗自己承認在7次奪冠的環法自行車賽中都服用了EPO及其他興奮劑藥物,但他實際沒有在當時任何一次興奮劑測試中被真正確認爲EPO陽性。到底是“道高一尺”還是“魔高一丈”,我們還要拭目以待。
它,如何成就諾獎
最後聊兩句EPO和2019年諾貝爾生理學或醫學獎間的聯繫。
EPO是人體感受並響應低氧最典型的案例,所以Semenza和Ratcliffe這兩位諾獎得主不約而同選擇以EPO入手研究細胞對低氧感知與適應機制,第一步就是尋找EPO基因能夠響應氧氣變化的元件。Semenza在編碼EPO蛋白的基因序列下游3’端找到一段256個鹼基關鍵的非編碼序列,命名爲低氧應答元件(hypoxia response element)。如果突變或刪除這段元件序列,EPO蛋白就對低氧的響應能力大大下降。如果把這段元件序列融合到其他與其他與低氧無關的基因下游3’端,這些改造後的基因在低氧條件下也出現了類似EPO的激活。
隨後Ratcliffe課題組發現,這一低氧應答元件並不只存在於負責生成EPO的腎臟或者肝臟細胞中,在其他更多的細胞類型中,都能在低氧條件下發揮作用。換句話說,這種對低氧的響應可能並不是EPO所專有的,而是細胞中更廣泛存在的一種現象。這些不負責生成EPO的其他細胞中必定含有某些分子(比如負責開啓基因表達的轉錄因子)能夠感受到氧氣濃度的變化,結合到低氧應答元件上開啓EPO等基因的表達。
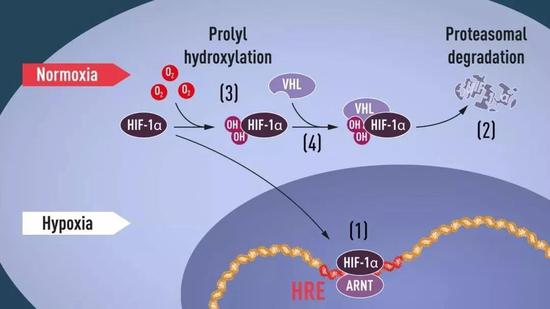
細胞響應低氧的分子機制。正常氧氣條件下,低氧誘導因子HIF-1α被修飾反應添上了兩個羥基(-OH),就能夠被VHL識別並打上了“待分解”標籤,從而被蛋白酶體分解。低氧情況下HIF-1α的羥基化反應無法發生不會被降解能在細胞中穩定存在,和ARNT組合成缺氧誘導因子HIF,能結合到特定的低氧應答元件(HRE),開啓EPO類似基因的表達。(圖片來源:https://www.nobelprize.org/)
而低氧應答元件的發現,也爲找到這類轉錄因子提供了工具。Semenz課題組的王廣良博士用EPO基因的低氧應答元件作鉺,在幾百升細胞裂解液中釣到了一個叫低氧誘導因子1(hypoxia-inducible factor 1, HIF-1)。最終HIF-1被證實正是響應低氧上調EPO基因的轉錄因子,但它並不僅僅只負責調控EPO基基因的表達,它的下游至少有幾百個基因,廣泛地參與包括腫瘤生成在內的生物學進程。在近期的諾獎解讀文章中已有很多的介紹,這裏就不贅述了。