喜訊 | 王福俤團隊在《生命科學》發表封面綜述——錳代謝研究進展
近期,營養髮現團隊又傳喜訊啦!
王福俤團隊在覈心期刊《生命科學》在線發表了封面綜述 “錳離子轉運蛋白的發現及功能機制研究進展”[1]。
該綜述針對錳離子轉運蛋白的發現、研究進展、相關疾病及動物模型進行綜述,爲錳代謝研究提供重要思路。王福俤教授和閔軍霞教授爲共同通訊作者。
錳是地殼最豐富的元素之一,其總量在金屬元素中位列第五位。錳離子是維持人體健康的必需微量元素,其缺乏或過量都會引發系列重大健康問題。錳作爲機體多種重要酶的輔因子,如精氨酸酶、丙酮酸脫羧酶、β-1,4-半乳糖基轉移酶及錳超氧化物歧化酶,廣泛參與發育與生殖、免疫反應、能量代謝及抗氧化等重要生理過程[2]。錳缺乏主要導致個體生長遲緩,骨骼發育不良,葡萄糖不耐受,脂肪和碳水化合物代謝紊亂等系列症狀[3]。
膳食攝入是人體補充錳元素的主要來源,錳存在於多種多樣的日常膳食中,其中以豆類、穀物及堅果中的含量尤爲豐富[4]。錳作爲添加劑在工業生產及製造業中被廣泛使用;長期暴露於錳行業作業環境,可以導致機體錳蓄積從而引發職業性錳中毒,出現類似於帕金森疾病的神經損傷、運動障礙、肝硬化等疾病[5,6]。 目前,人類對錳離子代謝的研究和認識遠遠滯後於鐵、鋅及銅等微量元素。
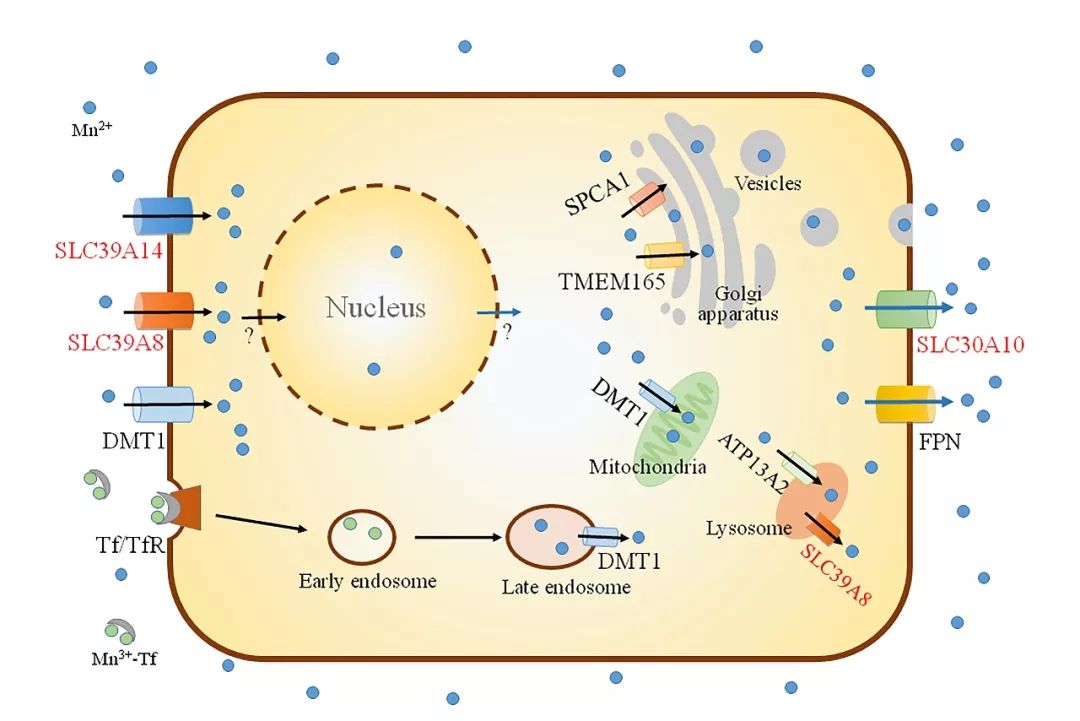
機體或細胞錳離子的穩態維持受多個離子轉運蛋白的調控(如下圖)。近年介導錳離子轉運的三個最關鍵的錳轉運蛋白SLC30A10[7]、SLC39A8[8] 和SLC39A14[9] 被相繼發現,這些基因突變可直接導致錳代謝異常引起的人類遺傳病。關鍵基因的發現真正開啓了錳代謝研究的新時代。
錳離子的細胞穩態代謝模式圖(《生命科學》封面圖片)
王福俤教授團隊在錳代謝領域獲得了重要進展,2017 年先後利用基因突變斑馬魚和基因敲除小鼠揭示SLC30A10和SLC39A14轉運錳離子的新機制,分別發表在國際著名期刊《PLoS Genetics》[10]和《Cell Discovery》[11]。相關基因敲除或轉基因模式動物模型不僅能夠模擬人類錳代謝異常的症狀,而且有助於深入研究這些錳離子轉運蛋白在器官和細胞內的功能及其分子調控機制,從而爲錳穩態調控研究注入了無限的活力。
鄭州大學公共衛生學院精準營養創新中心爲第一作者單位;研究生黃鑫、李玲玲和王君豪爲共同第一作者。浙江大學醫學院爲合作單位,閔軍霞教授參與部分工作。該成果得到了科技部國家重點研發計劃及國家自然科學基金委等基金資助。
論文作者工作照
《生命科學》,1988年創刊,是由國家自然科學基金委員會生物科學部、中國科學院前沿科學與教育局、中國科學院生命科學和醫學學部和中國科學院上海生命科學研究院共同主辦的全國性學術性期刊。
參考文獻
[1] 黃鑫#,李玲玲#,王君豪#,閔軍霞*,王福俤*.錳離子轉運蛋白的發現及功能機制研究進展.生命科學,2018,30(6):1-12
論文鏈接:http://www.lifescience.net.cn/arts.asp?doi=10.13376/j.cbls/2018073
[2] David W. Christianson. Structural chemistry and biology of manganese metalloenzymes. Prog Biophys Mol Biol, 1997, 67(2-3):217-52
[3] Vanessa A.Fitsanakis, Catherine Au, Keith M.Erikson, Michael Aschner. The effects of manganese on glutamate, dopamine and gamma-aminobutyric acid regulation. Neurochem Int, 2006, 48(6-7):426-33
[4] Pan Chen, Sudipta Chakraborty, Somshuvra Mukhopadhyay, Eunsook Lee, Monica MB Paoliello,Aaron B Bowman, Michael Aschner. Manganese homeostasis in the nervous system. Journal of Neurochemistry, 2015, 134(4):601-610
[5] Jonathan E Myers,Mary Lou Thompson,Suzan Ramushu,Taryn Young, Mohamed F Jeebhay, Leslie London, Eric Esswein, Kevin Renton, Adri Spies, Andrew Boulle, Inakshi Naik, Anders Iregren, David J Rees. The nervous system effects of occupational exposure on workers in a South African manganese smelter. Neurotoxicology, 2003, 24(6):885-94
[6] Rosemarie M.Bowler,Sabine Gysens,Emily Diamond, Sanae Nakagawa, MarijaDrezgica,Harry A.Roels. Manganese exposure: neuropsychological and neurological symptoms and effects in welders. Neurotoxicology, 2006, 27(3):315-26
[7] Karin Tuschl, Peter T. Clayton, Sidney M. Gospe, Jr., Shamshad Gulab, Shahnaz Ibrahim, Pratibha Singhi, Roosy Aulakh, Reinaldo T. Ribeiro, Orlando G. Barsottini, Maha S. Zaki, Maria Luz Del Rosario, Sarah Dyack, Victoria Price, Andrea Rideout, Kevin Gordon, Ron A. Wevers, W.K. “Kling” Chong, Philippa B. Mills. Syndrome of hepatic cirrhosis, dystonia, polycythemia, and hypermanganesemia caused by mutations in SLC30A10, a manganese transporter in man. Am J Hum Genet, 2012, 90(3):457-66
[8] Julien H. Park, Max Hogrebe, Marianne Grüneberg, Ingrid DuChesne, Ava L. von der Heiden, Janine Reunert, Karl P. Schlingmann, Kym M. Boycott, Chandree L. Beaulieu, Aziz A. Mhanni, A. Micheil Innes, Konstanze Hörtnagel, Saskia Biskup, Eva M. Gleixner, Gerhard Kurlemann, Barbara Fiedler, Heymut Omran, Frank Rutsch, Yoshinao Wada, Konstantinos Tsiakas, René Santer, Daniel W. Nebert, Stephan Rust, Thorsten Marquardt. SLC39A8 Deficiency: A Disorder of Manganese Transport and Glycosylation. Am J Hum Genet, 2015, 97(6):894-903
[9] Karin Tuschl, Esther Meyer, Leonardo E. Valdivia, Ningning Zhao, Chris Dadswell, Alaa Abdul-Sada, Christina Y. Hung, Michael A. Simpson, W. K. Chong, Thomas S. Jacques, Randy L. Woltjer, Simon Eaton, Allison Gregory, Lynn Sanford, Eleanna Kara, Henry Houlden, Stephan M. Cuno, Holger Prokisch, Lorella Valletta, Valeria Tiranti, Rasha Younis, Eamonn R. Maher, John Spencer, Ania Straatman-Iwanowska, Paul Gissen, Laila A. M. Selim, Guillem Pintos-Morell, Wifredo Coroleu-Lletget, Shekeeb S. Mohammad, Sangeetha Yoganathan, Russell C. Dale, Maya Thomas, Jason Rihel, Olaf A. Bodamer, Caroline A. Enns, Susan J. Hayflick, Peter T. Clayton, Philippa B. Mills, Manju A. Kurian, Stephen W. Wilson. Mutations in SLC39A14 disrupt manganese homeostasis and cause childhood-onset parkinsonism-dystonia.Nature Communications, 2016, 7:11601
[10] Zhidan Xia#, Jiayu Wei#, Yingniang Li, Jia Wang, Wenwen Li, Kai Wang, Xiaoli Hong, Lu Zhao, Caiyong Chen, Junxia Min*, Fudi Wang*.Zebrafish slc30a10 deficiency revealed a novel compensatory mechanism of Atp2c1 in maintaining manganese homeostasis. PLoS Genet, 2017, 13(7):e1006892
[11] Yongjuan Xin#, Hong Gao#, Jia Wang#, Yuzhen Qiang, Mustapha Umar Imam, Yang Li,Jianyao Wang, Ruochen Zhang, Huizhen Zhang, Yingying Yu, Hao Wang, Haiyang Luo, Changhe Shi,Yuming Xu, Shintaro Hojyo, Toshiyuki Fukada, Junxia Min, Fudi Wang*. Manganese transporter Slc39a14 deficiency revealed its key role in maintaining manganese homeostasis in mice. Cell Discovery, 2017, 3:17025
爲我們營養髮現的小夥伴豎起大拇指,請戳下方的大拇指一起分享吧!