輝瑞主動斷腕,禮來減重24%,歐盟提示致癌風險!這款減肥神藥究竟前景如何
今年爆火的GLP-1(胰高血糖素樣肽1,glucagon-like peptide-1)類減肥藥研究進展近期遭遇冰火兩重天。
當地時間6月26日,全球製藥巨頭輝瑞( PFE.US)宣佈,終止口服GLP-1候選藥物Lotiglipon(每日一次)的開發,終止的決定主要是基於安全性考量,包括來自一期藥物相互作用研究的藥動學數據,以及在一期研究和正在進行的二期研究測量的轉氨酶升高結果。
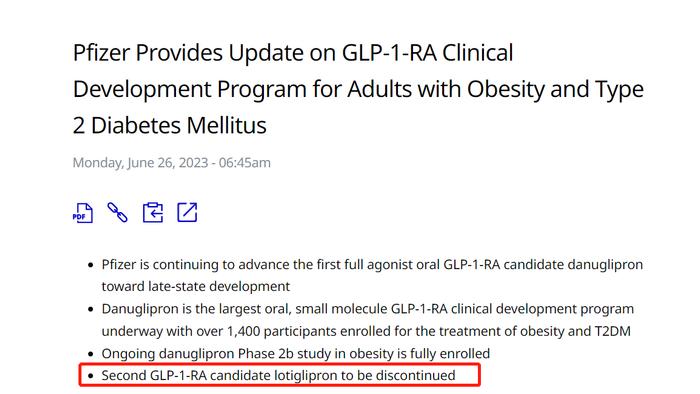
輝瑞終止一款GLP-1類藥物的研發
或受上述消息影響,輝瑞26日股價一度下跌5.59%,逼近2021年4月9日底部的35.9美元,最終收跌3.68%,報36.89美元/股。
這不是第一個被終止的GLP-1類藥物。也是在6月,阿斯利康(AZN.US)終止了旗下口服GLP-1候選藥物AZD0186的臨牀研發,原因是其療效和耐受性未能優於目前正在開發或已經上市的其他藥物。今年4月,阿斯利康宣佈,放棄已經進入2b/3期階段的GLP-1/GCGR雙靶點激動劑Cotadutide,原因是相關數據顯示該藥在降糖和減重上與另一款已上市的GLP-1類藥物利拉魯肽相比沒有顯示出更明顯的優勢。
由於在降糖、減重、非酒精性脂肪肝等方面的巨大前景,GLP-1類藥物成爲全球醫藥行業都在關注的明星產品。藥企巨頭的終止決定無疑給GLP-1賽道潑了冷水,但GLP-1減重賽道的熱度並未因此衰減。
在當地時間6月23日至26日舉辦的第83屆美國糖尿病協會(ADA)科學年會上,諾和諾德、禮來、勃林格殷格翰、恆瑞醫藥、先爲達生物等國內外藥企,均亮出了減重相關的積極數據,全球GLP-1領域的競賽依然在持續。
一年最高減重24.2%,多家藥企公佈GLP-1類藥減重數據
GLP-1類藥物最初用於糖尿病治療,自2014年諾和諾德GLP-1受體激動劑利拉魯肽的肥胖適應證在美國獲批,其減肥前景備受期待。作爲全球糖尿病領域頂級學術盛宴之一,今年的ADA年會國內外多款GLP-1類藥減重相關的數據反而引發不小的關注。
當地時間6月26日,禮來(LLY.US)宣佈,其實驗性藥物retatrutide的二期研究數據在ADA年會上發佈,顯示24周時,retatrutide(1 mg、4 mg、8 mg或12 mg)達到了肥胖或超重而無糖尿病參與者療效評估的主要終點,平均體重減輕17.5%。在次要終點中,在48周治療結束時平均體重減輕了24.2%。Retatrutide是禮來的在研靶向葡萄糖依賴性促胰島素多肽、胰高血糖素樣肽1和胰高血糖素受體的激動劑。一年減重24.2%的數據,目前來看是各家GLP-1類藥物減重效果最明顯的一款。

禮來公佈的retatrutide核心註冊研究
除了retatrutide,禮來的GIP/GLP-1受體激動劑替爾泊肽在減重領域走在更前面。4月27日,禮來曾宣佈,SURMOUNT-2研究結果顯示,替爾泊肽(10 mg和15 mg)在72周的研究中取得了優效於安慰劑的減重效果,受試者體重降低高達15.7%。
諾和諾德已經靠GLP-1類藥物司美格魯肽針劑減肥適應證賺得盆滿鉢滿,該公司與禮來在減肥適應證方面的競爭一直處於膠着狀態,ADA年會期間,諾和諾德(NVO.US)公佈了口服版司美格魯肽的研究進展。
據路透社報道,諾和諾德6月25日表示,臨牀試驗結果顯示, 接受50毫克劑量口服版司美格魯肽治療的受試者在68周裏平均減重15.1%,與先前的研究結果相符。諾和諾德稱,計劃於今年稍晚向歐、美監管部門申請該藥的上市。
對於患者而言,口服藥較針劑使用起來更爲方便,依從性更好,如果能搶先上市,諾和諾德在減肥領域的位置將更加穩固。
此外,德國企業勃林格殷格翰與Zealand Pharma合作開發的胰高血糖素/GLP-1受體雙重激動劑survodutid二期研究數據在大會上公佈,顯示接受46周治療、不伴有2型糖尿病的超重或肥胖受試者中,survodutide的療效優於安慰劑。在接受survodutide治療的兩個最高劑量組中,高達40%的受試者體重下降至少20%。在survodutide 4.8 mg劑量組中,體重下降15%或更多的受試者比例爲67%。
除了跨國藥企巨頭們,國內藥企在ADA減重研究方面也博得一席之地。
恆瑞醫藥(600276)有兩款GLP-1類藥物亮相此次年會,其中新型口服小分子GLP-1RA(HRS-7535)的一期研究數據涉及減重,研究數據顯示,單次遞增劑量(SAD)和多次遞增劑量(MAD)均具有可接受的安全性和良好藥代動力學(PK)和藥效學(PD),且受試者體重明顯下降。其中在MAD中,使用HRS-7535的受試者第29天時的體重自基線平均下降4.38kg。
新興創新藥企先爲達生物在年會上展示公佈新型GLP-1受體激動劑Ecnoglutide的多項研究積極結果。據先爲達生物官方公衆號介紹,一項針對Ecnoglutide(XW003)在成年肥胖患者中的開放標籤、陽性對照的臨牀二期療效評估研究顯示,治療26周後,Ecnoglutide 1.2mg、1.8mg和2.4mg組的受試者體重分別較基線降低11.5%、11.2%和14.7%。
先爲達生物還提到,今年年初啓動Ecnoglutide中國Ⅲ期註冊臨牀試驗的受試者招募,包括評估周注射劑Ecnoglutide在成年超重/肥胖患者(最高劑量爲2.4mg)的安全性和有效性,試驗目前均已完成全部受試者入組,預計將於2024年獲得頂線數據。
GLP-1研發冷思考:競爭激烈,甲狀腺癌風險不容忽視
華創研報指出,2022年全球GLP-1RA銷售額已超過220億美元,國內的銷售額也接近60億元。面對如此巨大的市場前景,即使終止了某一款藥的研發,但藥企們並未完全放棄GLP-1管線的佈局。
輝瑞在官宣終止的同時也表示,將繼續推進另一款每日兩次口服GLP-1激動劑Danuglipron的臨牀開發計劃,還在開發該藥每日一次的口服版本。阿斯利康的產品管線中依然包括GLP-1類藥,包括每週一次的GLP-1R/GCGR雙重激動劑AZD9550。
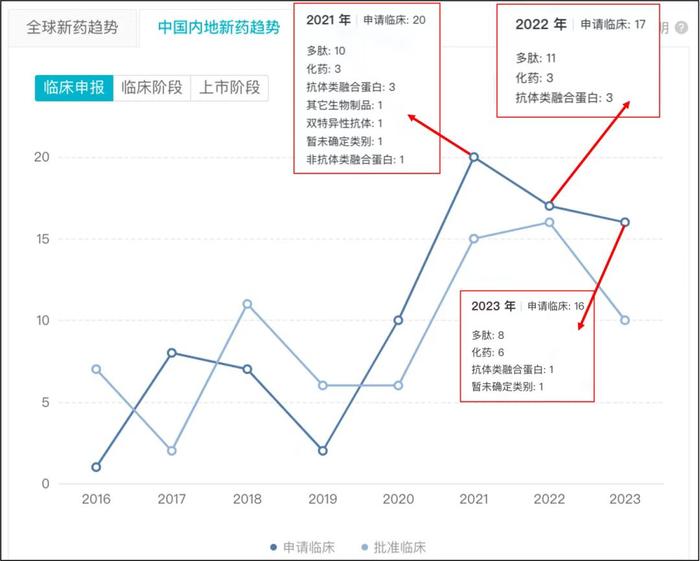
國內GLP-1類新藥申報趨勢 來源:insight數據庫
醫藥魔方NextPharma數據庫顯示,目前全球有超過150款GLP-1新藥在研。Insight數據庫顯示,目前國內已有112款GLP-1新藥進入臨牀階段。在潛在競爭激烈,而數據不佳的情況下,跨國藥企主動棄子,也就不難理解。
有醫藥行業人士向澎湃新聞記者表示,幾款藥物的終止不會否定一大類藥物的價值,但某種程度上,這盆“冷水”反而讓藥企乃至整個行業得以更加理性地看待GLP-1類藥物,要慎重佈局,避免進入PD-1腫瘤藥“內卷”式的局面。
積極的減重效果是GLP-1研發企業的底氣,但對於患者而言,對這類藥物的安全性仍要持慎重的態度。
近期,歐盟藥品監管局(EMA)提示GLP-1藥物可能存在致甲狀腺癌的風險,要求相關藥企於7月26日前提交更多信息。EMA還表示,已經加強對GLP-1治療的審查。
此次風險提示波及諾和諾德、禮來、阿斯利康、賽諾菲等多家藥企,適應證包括糖尿病、減重。EMA表示,GLP-1類藥物用於減重是否也會存在像糖尿病患者使用時一樣會增加患甲狀腺癌的風險仍需試驗證明。
諾和諾德是目前唯一擁有減肥適應證GLP-1類藥物的企業,對於上述風險提示,該公司回應稱,試驗和上市後監測的安全數據並未發現該藥物與甲狀腺癌之間存在因果聯繫,已收到歐盟藥品監管局要求提供有關藥物的信息,並將對有關該問題的所有相關數據進行徹底審查。
實際上,甲狀腺癌風險並不是一個新問題。以諾和諾德司美格魯肽爲例,其說明書列出了9大類不良反應,涉及免疫系統、神經系統、胃腸系統等。FDA在獲批該藥的減肥適應證時還特別提醒,該藥的處方信息包含一個黑框警告,告知醫療專業人員和患者存在甲狀腺癌的潛在風險。此外,該藥不能應用於有甲狀腺髓樣癌個人史或家族史的患者。
此前,有國內醫生也曾向澎湃新聞記者強調,GLP-1類藥物屬於處方藥,使用前需要對患者進行用藥前評估,其使用也存在禁忌證,比如患有甲狀腺髓樣癌病史或者家族史的患者,以及2型多發性內分泌腺瘤病的患者都不建議使用。
上述醫藥行業人士認爲,新藥研發向來“九死一生”,減肥藥自帶一定的消費屬性,受衆羣體較大,有效性之外,安全性也不容忽視,這些都需要藥企依靠紮實的研究結果來證明。