百利天恆8億美元首付款訂單背後:全球研發費用是否需要承擔?
出品:新浪財經上市公司研究院
作者:天利
12月12日,百利天恆早間開盤20cm一字漲停,截至當日下午收盤,公司股價報131.11元/股創歷史新高。消息面上,公司早間公告,全資子公司SystImmune和百時美施貴寶(BMS)日前宣佈就SystImmune的BL-B01D1達成獨家許可與合作協議。
合作協議生效後,BMS將向SystImmune支付8億美元的首付款,達成開發、註冊和銷售里程碑後,SystImmune將獲得最高可達71億美元的額外付款,潛在總交易額最高可達84億美元。然而,在對相關資料進行梳理後發現,百利天恆於該項交易中能夠收穫的實際利益難以衡量,公司對於全球研發費用是否需要分擔的表述不夠清晰,且或存在前後矛盾。
產品具備市場潛力
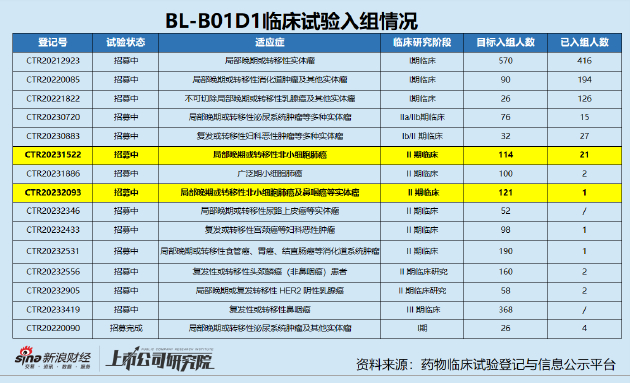
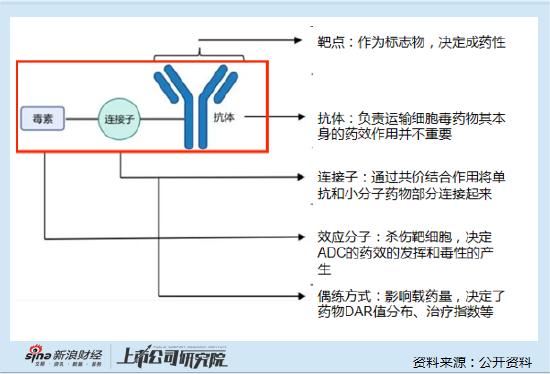
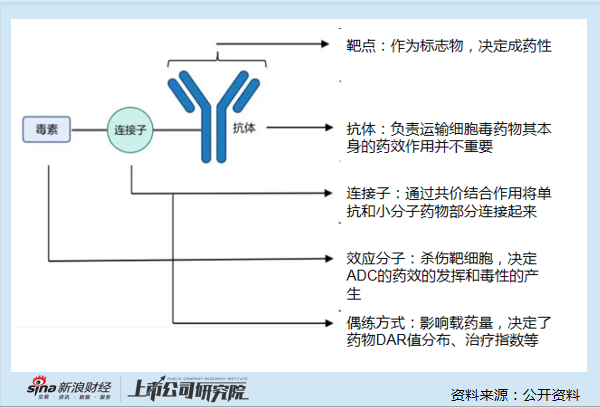
資料顯示,BL-B01D1是一種基於雙特異性拓撲異構酶抑制劑的ADC,可同時靶向作用於表皮生長因子受體和人表皮生長因子受體3(EGFR X HER3)。目前正在開展全球多中心I期臨牀研究(BL-B01D1-LUNG101),以評估其在轉移性或不可切除的非小細胞肺癌(NSCLC)患者中的安全性和有效性。
此前,BL-B01D1的早期臨牀研究數據已在2023年的美國臨牀腫瘤學會年會(ASCO)、歐洲醫學腫瘤學會年會(ESMO)以及聖安東尼奧乳腺癌研討會(SABCS)上被公佈。
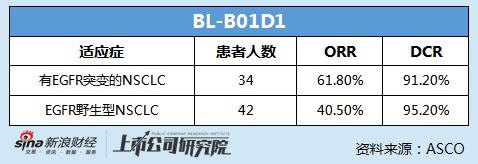
其中,BL-B01D1的FIH I期臨牀數據在2023ASCO上通過口頭報告的方式呈現。臨牀數據顯示,在34名有EGFR突變的NSCLC患者中,客觀緩釋率(ORR)達到61.8%,疾病控制率(DCR)達到91.2%;在42名EGFR野生型NSCLC患者中,ORR爲40.5%,DCR爲95.2%。
值得關注的是,入組的有EGFR突變的NSCLC患者此前均均接受過EGFR-TKI治療,且88%的患者接受過3代EGFR-TKI治療,68%的患者接受過含鉑化療。因此,BL-B01D1在治療EGFR耐藥的NSCLC方面具有較大潛力,且臨牀數據具備競爭力,同時安全性良好,未來或有希望突破EGFR-TKI耐藥這一難題,彌補市場空白。
8億美元首付款背後:全球研發費用如何分擔?
然而,儘管BL-B01D1已顯示出優秀的發展潛力,但目前仍僅讀出Ⅰ期臨牀數據,尚未走出完成臨牀Ⅱ期的新藥研發“死亡之谷”,產品未來的研發及商業化仍面臨較大的不確定性。那麼,BMS爲何要爲其豪擲8億美元首付款?
需要指出的是,License-out許可協議包括了首付款及後續利潤分配方案。由於潛在總交易額往往受限於管線對應適應症的市場規模以及利潤分配方案,且與研發進展高度相關,存在較大不確定性,而首付款多爲一次性支付且不可退回,因此首付款金額相對真實地反應了海外企業對於管線的價值評估。
而從國內外ADC藥物對外授權案例來看,如此高額的首付款十分罕見。以科倫博泰與默沙東的合作爲例,科倫將其管線中七種不同在研臨牀前 ADC 候選藥物項目以全球獨佔許可或獨佔許可選擇權形式授予默沙東,里程碑付款合計93 億美元,但首付款也僅有1.75 億美元。
從適應症看,同樣聚焦治療EGFRmut NSCLC的TROP2 ADC SKB264,Ⅰ期臨牀結果顯示客觀緩釋率並不輸於百利天恆的BL-B01D1,但其授權給默沙東時的首付款也僅有4700 萬美元。
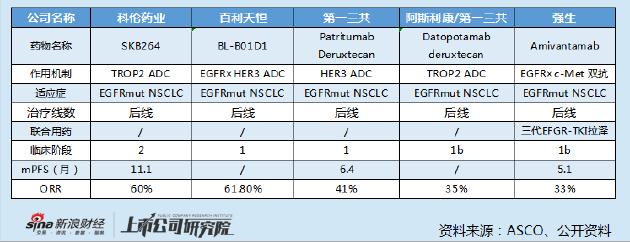
唯一首付款高於BL-B01D1授權案例的爲初代靶向HER2的ADC藥物DS-8201,2019年03月28日,阿斯利康宣佈第一三共達成協議,在全球範圍內合作開發DS-8201,首付款13.5億美元,里程碑金55.5億美元,總金額達69億美元。
彼時DS-8201治療HER2低表達乳腺癌已進入關鍵性全球III期臨牀研究,並已於2019年1月完成首例患者給藥。同時,第一三共在公告中已明確,雙方將分別承擔產品研發50%的研發費用,這或也是該項合作協議首付款較高的原因之一。

需要指出的是,在新藥研發全流程中,臨牀試驗階段是研發費用支出的大頭,且隨着臨牀進度的推進研發費用逐步增多。其中:
I期臨牀試驗:在少量(通常20到80人)健康志願者或患者身上測試藥物的安全性、耐受性、代謝和藥效。這個階段通常需要1到2年,花費約爲800萬-2.5億美元。
II期臨牀試驗:在較多(通常幾十到幾百人)患者身上測試藥物的有效性、劑量和副作用。這個階段通常需要2到3年,花費約爲2000萬-3.5億美元。
III期臨牀試驗:在更多(通常幾百到幾千人)患者身上與現有治療方案進行比較,以證明藥物的優勢和安全性。這個階段通常需要3到4年,花費約爲3000萬-5億美元。
百利天恆2023年半年報顯示,BL-B01D1目前正處於II期臨牀研究階段,已累計投入研發費用約2.12億元。可以預見的是,未來的研發投入還將進一步提升。同時,海外臨牀試驗成本遠高於國內,通常爲國內的3倍以上,因此產品後續的研發費用如何分擔尤爲值得關注。
百利天恆公告顯示,“根據合作協議,雙方將合作推動BL-B01D1在美國的開發和商業化。SystImmune將通過其關聯公司獨家負責BL-B01D1在中國大陸的開發、商業化以及在中國大陸的生產,並負責生產部分供中國大陸以外地區使用的藥品。BMS將獨家負責BL-B01D1在全球其他地區的開發和商業化。”
同時,協議的主要內容部分存在如下表述,“SystImmune與BMS將分擔BL-B01D1全球開發費用,以及在美國市場的利潤和虧損。”
創新藥管線所帶來的虧損主要集中在研發費用,按照協議的主要內容部分表述,或可理解爲公司將與BMS分擔包括海外臨牀試驗在內的研發費用,而公司同時又表示BMS將獨家負責BL-B01D1在全球其他地區的開發和商業化,是否存在表述不清之嫌?公司能否明確相關研發費用如何劃分?